胡凯主任:一文盘点R/R DLBCL靶向及免疫治疗进展——来看看谁是「明日之星」?
弥漫大B细胞淋巴瘤(DLBCL)是成人最常见的淋巴瘤亚型,具有高度侵袭性。DLBCL约占全球非霍奇金淋巴瘤(NHL)每年新诊断病例的32.5%,而在中国人群中DLBCL所占比例更高,可达50%以上。从DLBCL的疾病特点上来看,病程进展快速,如未得到有效治疗,中位生存期仅数月。令人唏嘘的是DLBCL患者标准一线治疗后仍有40%成为难治/复发病例,尚无标准治疗方案。
DLBCL的基因亚型分类又有哪些新进展?
DLBCL为何总是无法逃脱复发/难治的“命运”?这是因为DLBCL具有高度异质性,不同起病部位、不同IPI评分、不同细胞起源、不同生物标志物等特性都造成其临床表现、治疗方案多样。
因此,需进一步分析其生物学背景,才能为选择靶向治疗进一步提供可能性。
一项研究基于公开队列数据构建LymphGen概率分类工具,确定7类DLBCL遗传亚型,对不同遗传亚型的基因特征进行分析并与治疗敏感性建立关联[1],如下图所示:
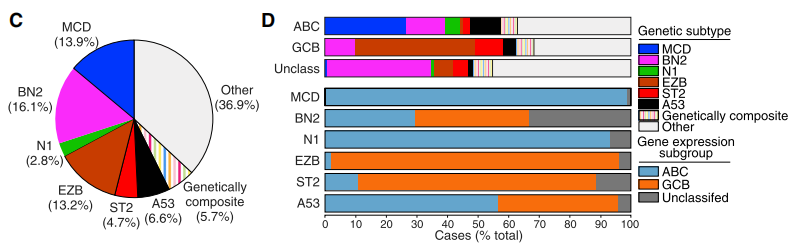
图1 各种基因亚型的发生率%
DLBCL基因亚型与发病机制的相关性及其潜在治疗靶点,如下图所示:
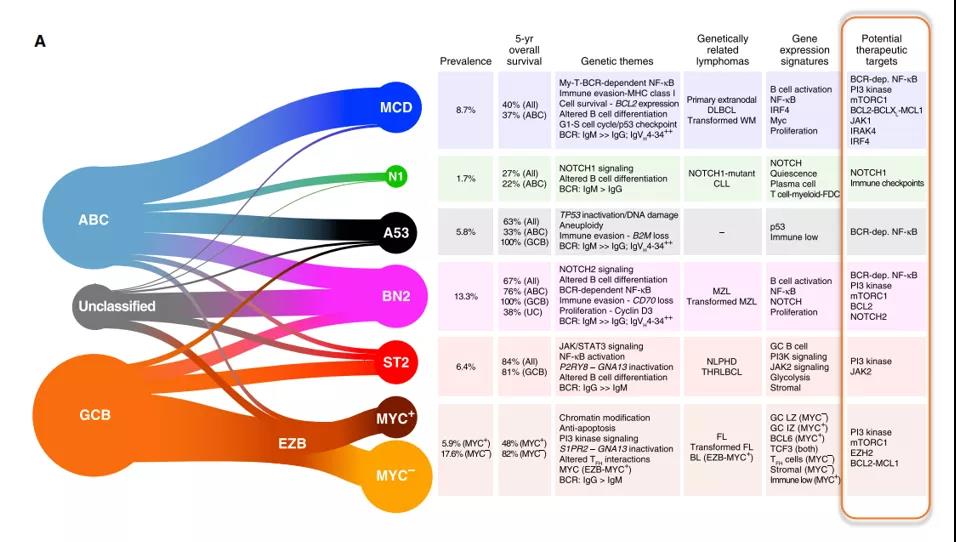
图2
不同治疗靶点到底能选用哪些药物?
应用于DLBCL的治疗模式主要可以分为以下四种:CAR-T、单抗、双抗以及靶向药物。
不同类型的药物对应的总体缓解率(ORR)有所不同,如下所示:
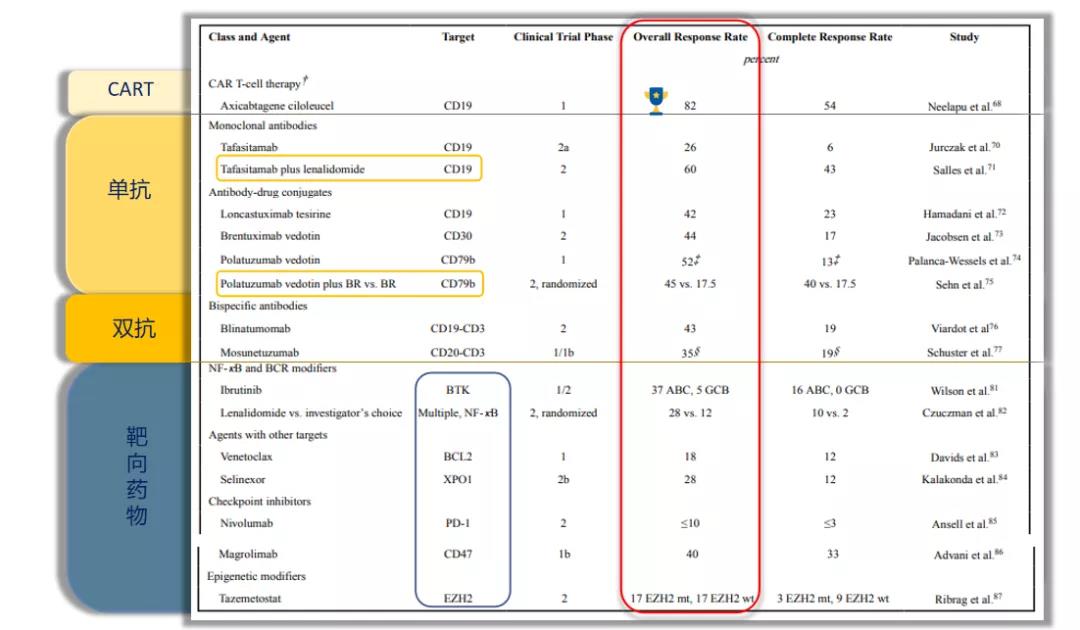
图3 靶向应用于DLBCL的CART、抗体及药物及治疗反应率
BTK抑制剂
MCD亚型DLBCL依赖BCR信号的长期激活,因此,对抑制BCR信号通路的BTK抑制剂敏感。一项Ⅰ/Ⅱ期临床研究纳入80例复发或难治性DLBCL患者,给予伊布替尼单药治疗,研究结果显示:CD79B突变的患者中,伊布替尼治疗的缓解率为55.5%,31%的CD79B野生型的肿瘤亦有应答;不同MYD88突变状态的DLBCL患者伊布替尼的缓解率无显著差异 (突变 vs 野生型 33.3% vs 40%; P=0.493);伊布替尼治疗CD79B和MYYD88均突变的DLBCL患者缓解率显著升高,达80%[2]。
BTK抑制剂在BN2亚型可能受益,但需循证医学证据来证实。除此之外,BTK抑制剂可改善MYC/BCL2双表达患者预后。Phoenix研究结果显示含BTKi方案可改善MYC/BCL2双表达患者无事件生存(EFS)率[3]。
来那度胺
来那度胺通过抑制IRF4的表达,下调NF-kB的活化,诱导肿瘤细胞凋亡,并且具有直接免疫杀伤及多重免疫调节作用。同时,来那度胺的联合用药模式前景初现——既往有研究显示,来那度胺与伊布替尼联用可以达到“1+1>2”的效果。该研究纳入了≥18岁、不适合移植、复发/难治(R/R) Non-GCB DLBCL患者,研究结果显示总客观缓解率(ORR)为47%,完全缓解率(CR)为31%;中位无进展生存期(PFS)均为5个月,达到CR的患者中位PFS为21个月;中位中生存期(OS)为14个月[4]。
来那度胺还可以增强CAR-T后疾病进展的疗效,研究结果显示:CAR-T治疗失败后接受来那度胺治疗的患者ORR和CR率更高且CAR-T扩增水平更高。其背后机制可解释为来那度胺可激活CD8 T细胞,抑制调节性T细胞并恢复T细胞免疫突触。CAR-T细胞输注后复发时接受来那度胺治疗可能会带来高缓解率,尤其是在输注后早期接受来那度胺的患者中[5]。
BCL2抑制剂
BCL2抑制剂耐药与其它抗凋亡蛋白如Bcl-XL、Bcl-W、Mcl-1等相关,与其它药物联用可逆转或减少耐药。BCL2抑制剂联合苯达莫司汀及利妥昔单抗治疗R/R DLBCL结果显示:整个研究人群ORR为65%,DLBCL为41%,中位PFS为10.7个月;BCL-2高表达的患者,PFS延长[6]。
BCL2抑制剂联合BTK抑制剂+来那度胺治疗R/R DLBCL的研究结果显示:难治性患者ORR为52%,CR率达29%;复发性患者ORR率为86%,CR率高达68%[7]。
西达本胺
表观遗传因子突变是西达本胺作用的基础,HDAC抑制剂可以提高乙酰化水平,恢复乙酰化的生理平衡状态,从而抑制肿瘤。研究结果显示:西达本胺+DICE治疗R/R DLBCLC+DICE 整体人群ORR 62.5% , CR 26.8%;西达本胺+DICE二线治疗ORR 75.0%,CR 34.4%[8]。
核输出蛋白(XPO1)抑制剂
XPO1抑制剂能够抑制致癌蛋白从细胞核输出,在DLBCL细胞中XPO1高表达,其中60%R/R DLBCL患者XPO1高表达(>70%)。Selinexor单药治疗使部分R/R DLBCL获得深度、持久的疗效:ORR为28.3%, CR为12% (GCB亚组ORR:34%);中位缓解持续时间(mDOR)为9.2月 (CR: 23月),中位OS为9.1月 (CR/PR:未达到)。
既往治疗线数较多的患者仍能获得较好的缓解,既往接受过ASCT治疗的患者临床获益最大,ORR为42.1%,mDOR为23个月。无论年龄是≧65岁或<65岁的人群,还是不同肾功能的病人,Selinexor不良事件发生率类似[9]。
同时,XPO1抑制剂与顺铂、吉西他滨、阿霉素、依托泊苷等化疗药物有协同作用;与BCL2抑制剂、BTK抑制剂、PD-1单抗等也存在潜在协同作用。
PD-1抑制剂
研究显示,在R/R原发纵膈大B细胞淋巴瘤(PMBCL)中的PD-1抑制剂单药有效,在R/R PMBCL人群中PD-1抑制剂联合BV治疗的ORR为73%,CR为37%[10]。但在R/R DLBCL人群中未得到满意结果,仍在探索。
非细胞免疫治疗的现状如何?
R/R DLBCL中的细胞免疫及非细胞免疫治疗包括:CAR-T、抗体偶联类药物(ADC)、双抗等,几类药物的疗效对比如下图:
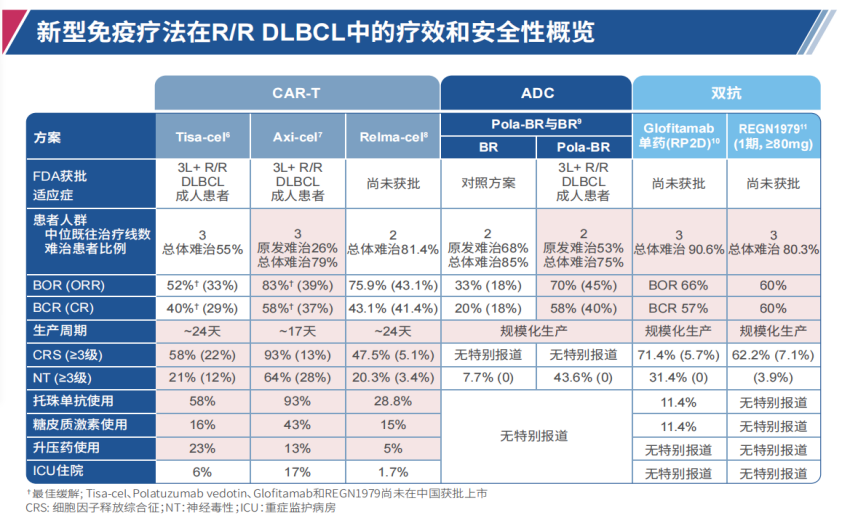
图4 新免疫疗法在R/R DLBCL中的疗效对比
Polatuzumab Vedotin(Pola)
Pola的作用机制为结合CD79b,发挥MMAE杀伤。研究结果显示无论先前治疗线数或是否耐药,在BR方案(苯达莫斯汀+利妥昔单抗)基础上增加Pola 可显著提高疾病缓解率, PFS 和OS[11]。同时,Pola联合化疗、抗体的多项临床试验正在不断进行中,旨在于寻找更加有效的治疗模式和组合。
CD3CD19双抗(Blinatumomab)
Blinatumomab凭借双特异性结合效应发挥作用,在临床试验中的表现显示接受Blinatumomab治疗一周期后的总缓解率为43%,其中CR率为19%[12]。
CD3CD20双抗
CD3CD20双抗代表性药物有:Glofitamab、Mosunetuzumab。其中Mosunetuzumab (mosun) 单药作为老年/unfit DLBCL患者的一线治疗表现出持续的有效性及安全性。
“乘风破浪”的细胞免疫治疗发展前景如何?
目前,两种第二代CAR-T疗法axicabtagene-ciloleucel和tisagenlecleucel已获得美国、欧洲和瑞士各自监管机构的批准(加拿大、日本和澳大利亚),其适应症包括:R/R侵袭性B细胞NHL、DLBCL、高级别B细胞淋巴瘤、PMBCL(仅适用于Axicabatene ciloleucel)、转化性滤泡淋巴瘤。
NHL患者转诊接受CAR-T治疗的关键考虑因素应该包括疾病预后因素、既往治疗史及其顺序、患者共患病及各器官功能、中枢神经系统(CNS)受累。
CAR-T细胞治疗R/R B细胞淋巴瘤的桥接治疗及预处理方案可包括:

图5 CAR-T治疗降低肿瘤负荷的桥接治疗策略
ZUMA-1试验报告了Axi-cel针对R/R NHL 的长期随访数据,结果显示:对于DLBCL Axi-cel可维持其深度和持久缓解状态,可能无需CAR-T细胞持续存在,后期体液免疫系统会逐渐恢复和重建,保证了治疗后长期的安全性[13]。
ZUMA-12试验是一项一线治疗高危B细胞淋巴瘤的多中心开放单臂临床研究,其研究结果显示:Axi-cel输注安全有效,ORR率85%,CR率74%;中位随访9.3个月后,70%的患者在随访截止时仍持续缓解,中位DOR、PFS及OS均未达到。在ZUMA-12试验中,与ZUMA-1试验相比,输注产品中CCR7+CD45RA+T细胞的更高(与CAR T细胞的更高扩增量相关),表明一线治疗中的T细胞适应性得到改善。
小 结
R/R DLBCL患者选择靶向及免疫治疗可获得疗效
需重新评估肿瘤基因突变合理选择联合治疗方案
双抗及异基因CAR-T等新的治疗值得期待
仍需探讨如何进一步提高治疗的持久疗效及长期生存率。
参考文献:
[1] Cancer Cell 37, 551–568, April 13, 2020
[2] Wilson WH, et al. Nat Med 2015; 21(8):922-926.
[3] Johnson P, et al. 2019 ASH abstract 354.
[4] 2019 ASH abstract 761
[5] Thieblemont G, et al. 62nd ASH Annual Meeting (2020). Abstract No:1115.
[6] Venetoclax, bendamustine, and rituximab in patients with relapsed or refractory NHL: a phase Ib dose finding study S. de Vos1*, L. J. Swinnen,D. Wang,et al.Annals of Oncology 29: 1932–1938, 2018
[7] Melani C, et al. 62nd ASH Annual Meeting (2020). Abstract No:598.
[8] Crump M, Kuruvilla J, Couban S, et al. Journal of Clinical Oncology, 2014, 32(31): 3490-3496.
[9] Lancet Haematol 2020;7: e511–22
[10] Zinzani P.L, et al. 2019 ICML abstract 108.
[11] Sehn LH, et al. ASCO 2018 oral presentation; Abstr #7507
[12] Viardot A, Goebeler M-E, Hess G, et al. Phase 2 study of the bispecific T-cell engager (BiTE) antibody blinatumomab in relapsed/refractory diffuse large B-cell lymphoma. Blood 2016;127(11):1410–1416.
[13] 1.Locke FL et al.Lancet Oncol.2019;20:31-42.2.Deneys V,et al.JImmunol Methods.2001:253:23-36,3.ScottGD,et al.Clin Pathol,2018:71:174-179.
Axi-cel, axicabtagene ciloleucel; CAR, chimeric antigen receptor; CR, complete response; KM, Kaplan-Meier;LBCL, large B cell lymphoma;mITT,modified intent-to-treat; ORR, objective response rate. 11 Jacobson et al ASH 2020 Abstract1187
