Leukemia | 李春富教授、张辉医生:首个CLL1 CAR-T治疗儿童R/R-AML多中心研究助力儿童AML治疗新发展
嵌合抗原受体T细胞(CAR-T)疗法在多种血液系统肿瘤取得了突破性进展,但既往在复发难治性急性髓系白血病(R/R-AML)的疗效不佳,缺乏理想靶点。
近日,由高博医学(血液病)广东研究中心南方春富(儿童)血液病研究院作为牵头单位、携手广州市妇女儿童医疗中心团队合作开展的C型凝集素样分子1 (CLL1) CAR-T治疗儿童R/R-AML的Ⅰ/Ⅱ期研究(NCT03222674)中期分析数据全文发表于国际权威期刊Leukemia杂志,疗效和安全性结果令人鼓舞。这是该领域首个发表的多中心临床研究报道,具有重要的引领性探索意义。为此,我们特邀主要研究者高博医学(血液病)广东研究中心南方春富(儿童)血液病研究院李春富教授,以及国家儿童医学中心(上海)、上海交通大学医学院附属上海儿童医学中心张辉医生(原广州市妇女儿童医疗中心血液肿瘤科医生)解读研究内容,分享探索经验,指导临床实践。

研究者说
【一】李春富教授访谈
●破局“杀敌一万 ,自损三千”:AML治疗亟需高特异性靶点
Q1:相较于B系肿瘤,CAR-T成功应用于AML面临哪些挑战?CLL1作为AML治疗靶点有何特点?
李春富教授:CAR-T疗法已历经十年发展,在多种血液系统肿瘤中疗效显著,例如最具代表性的CD19 CAR-T治疗急性B淋巴细胞白血病(B-ALL)。但AML的CAR-T治疗进展缓慢,其根本原因在于缺乏理想靶点、髓系功能受损缺乏相应的替代治疗。
具体言之,以B-ALL为例,尽管CD19 CAR-T也会杀伤表达CD19的正常B淋巴细胞,但其所导致的丙种球蛋白减少等问题可通过外源性补充来克服。AML则不然,髓系的抗原属性与B系有本质的区别,如果正常髓系细胞被CAR-T杀灭,由于缺乏替代治疗(比如白细胞),可能导致骨髓衰竭、严重感染甚至危及生命。
AML的靶点中,CLL1的特异性较CD123、CD33等相对更高,其在AML干细胞、大多数AML母细胞和正常髓系细胞上高表达,但在正常造血干细胞和淋巴细胞上基本不表达。由此,靶向CLL1的治疗不影响正常造血和淋巴细胞定向免疫功能,但同样会杀伤正常髓系细胞,导致粒细胞缺乏、血小板下降等。因此,尽管CLL1较既往探索的靶点有一定优势,但副作用仍比CD19 CAR-T更大。
●CLL1 CAR-T桥接allo-HSCT,提升治愈率
Q2:基于当前研究结果,您如何评价CLL1 CAR-T的治疗价值?本次中期分析数据为临床带来了哪些有益的启示?
李春富教授:从本研究中期分析结果可以看到,CLL1 CAR-T在儿童R/R-AML中有效率高、安全性总体较好。值得强调的是,CAR-T可以使一些患者获得治愈,但对于大部分患者而言,CAR-T是一种降低肿瘤负荷的手段;CLL1 CAR-T治疗后,具备移植条件的患者,都应尽量桥接异基因造血干细胞移植(allo-HSCT),以降低复发率、提升治愈率。目前本中心常规实践也是如此。
从作用机制的角度,AML是干细胞水平的病变,理论上,化疗、免疫治疗等手段通常都难以彻底治愈复发难治性疾病,患者需要终生持续的抗白血病效果存在,而只有HSCT才能实现。
●多靶点CAR-T克服免疫逃逸,替代或联合化疗减毒增效
Q3:AML的CAR-T治疗未来有哪些发展方向和临床前景?
李春富教授:免疫逃逸是CAR-T最主要的耐药机制之一,包括肿瘤细胞表面抗原表达的减少、丢失或不表达。因此,多靶点CAR-T联合或序贯使用是克服免疫逃逸的重要手段,也是后续探索的重要方向。AML的CAR-T治疗中,CLL1、CD38、CD117、CD123、CD33都是值得探索的联合靶点。
需要强调的是,多靶点CAR-T的目的是为了获得更深的疾病缓解、更大程度降低肿瘤负荷,后续桥接allo-HSCT仍是提高R/R-AML治愈率的重要策略。同时,桥接allo-HSCT(一般在CAR-T回输后10~30天内)也可有效缓解CAR-T带来的骨髓抑制不良反应,提高安全性。
回溯CAR-T自诞生至今的发展历程,最初大家寄希望于其能够替代HSCT、治愈白血病,但随着研究和实践和深入、随着时间的推移,学术界对CAR-T的价值定位也逐渐发生了变化。对于非难治性白血病,CAR-T有望替代化疗或联合化疗达到治愈,同时避免或减少化疗的毒副作用。但对于难治性疾病,尤其是干细胞水平的白血病,HSCT的治愈性地位仍难以取代,而CAR-T的作用更多地在于改善系统性药物治疗现状、使肿瘤负荷下降、为移植创造条件。
【二】张辉医生访谈
●特异性高表达于AML干/母细胞,CLL1有望成为重要靶点
Q1:当前针对AML的CAR-T靶点研究现状如何?CLL1有何特点?
张辉医生:关于AML的CAR-T靶点,学术界已经做了很多的探索,包括本研究中的CLL1,还有CD33、CD123、CD117、CD38、LewisY、TIM3等,但大部分尚停留在临床前研究阶段。而目前已经在临床中看到了明确疗效的,主要是CLL1这一靶点。
CLL1的特点是在AML干细胞和母细胞上强表达,但也并非所有患者均如此,所以理论上CLL1 CAR-T是对部分患者群体有效;同时,CLL1在正常造血干细胞上基本不表达,因此对正常造血影响较小。但CLL1在正常单核细胞也表达,因此经CLL1 CAR-T治疗后的患者单核细胞水平恢复较慢。
AML具有高度异质性、理想靶点非常有限、正常髓系细胞损伤后,除了HSCT尚无其他替代治疗,这些都是AML治疗尚待突破的瓶颈,还有很多需要解决的问题。
●深度降荷,安全可控,临床获益——CLL1 CAR-T首次多中心探索实践
Q2:您认为该研究有哪些亮点值得大家关注?研究开展过程中,您有哪些体会和经验可以分享?
张辉医生:对于R/R-AML患者,每一个有获益希望的治疗机会都弥足珍贵,没有机会时我们应该努力创造机会、应该做更多的尝试。这也是我们开展CLL1 CAR-T探索工作的初衷。
该研究是CLL1 CAR-T用于儿童R/R-AML治疗首个报道的多中心临床研究,为一部分患者的成功治疗带来了希望,总体安全性较好、不良反应可控,直观感觉不良反应比传统的高强度化疗明显更轻,具有推广应用的临床前景。目前尚无欧美国家的相关数据报道,希望国内同道携手,加速推进此项探索工作,以期让更多患者受益。
同时,从目前的治疗经验来看,我非常赞同李春富教授的观点,对于R/R-AML,CLL1 CAR-T的价值主要在于提高完全缓解(CR)率、深度降低肿瘤负荷,但并不能替代移植,而是作为移植前的桥接治疗,不能作为治愈的手段。回归到病理机制,AML是首个公认的干细胞来源的疾病,如果干细胞水平的“上游”未达稳态,则“下游”也很难调整。因此,CLL1 CAR-T治疗后,有条件的患者均应尽快桥接allo-HSCT。
●共刺激结构域改造、T细胞亚群选择、转染工艺改进——CLL1 CAR-T迭代升级方向
Q3:CLL1 CAR-T产品如何进一步提高疗效和安全性?
张辉医生:本团队既往尝试过两种共刺激分子的CLL1 CAR-T,分别是CD28/27和本研究报道的4-1BB。通过有限的病例数分析发现,两者疗效相当,但不良反应方面存在差异,后者副作用相对更小,但其突出特点是治疗反应较好的患者往往细胞因子释放综合征(CRS)明显,粒细胞、单核细胞缺失时间也较长,可能与体内扩增曲线和持续时间有关。
而4-1-BB作为共刺激结构域的CLL1 CAR-T肺部不良反应发生率较高,原因尚不清楚,可能与骨髓抑制相关感染有关,也可能与表达CLL1的肺间质细胞相关的“脱靶”毒性有关。受限于目前的病例数,这些假设仍需要进一步研究去证实。同时也提示我们,共刺激结构域的改造可能是CLL1 CAR-T迭代升级的一个重要方向,以进一步提高安全性和耐受性。
最后,无论是多靶点CAR-T的应用还是CAR-T联合其他药物治疗,如何与HSCT更好地衔接,也是我们要去思考的方向。
研究简介
【一】研究方法
本研究为单臂设计,招募了8例R/R-AML儿童患者,经3~5天环磷酰胺和氟达拉滨清淋预处理后,接受0.35×10⁶/kg~1×10⁶/kg剂量单次静脉回输自体抗CLL1的CAR-T细胞治疗。主要研究终点是评估CLL1 CAR-T的安全性和初步疗效。
该研究中制备的第二代CLL1 CAR-T具有4-1BB共刺激结构域和CD3z信号传导结构域,细胞外sCFv来源于高亲和力的小鼠CLL1单克隆抗体(采用杂交瘤技术生产)。
【二】主要结果
●基线特征
入组患者中位年龄12岁(8~16岁),中位基线AML肿瘤负荷为46.2%(14.2%~92.4%),CLL1阳性AML幼稚细胞中位占比88.5% (65.0%~96.0%)。基线资料详见表1。其中患者2未进行预处理。
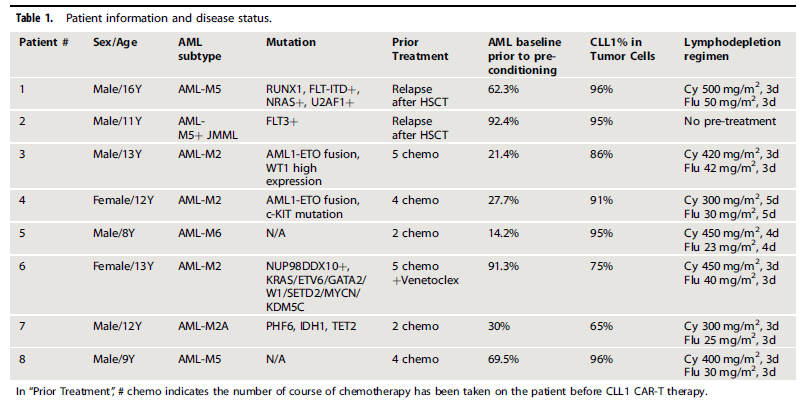
表1 患者信息和疾病状态
●CAR-T体内扩增
CAR-T细胞输注后的第一个月,所有患者体内均有效扩增,平均峰值时间为第10~12天。
●安全性
CAR-T回输后第一个月内,所有患者均出现CRS,均为1~2级,无任何致死事件,也未观察到免疫效应细胞相关神经毒性综合征(ICANS)和显著的脏器毒性。
●近期疗效
CAR-T回输后1个月内,8例患者中,4例(患者1、2、5、8)达到形态学无白血病状态(MLFS)和微小残留病变(MRD)阴性,1例为MLFS合并MRD阳性(患者7),1例达到完全缓解合并不完全血液学恢复(CRi)但MRD阳性(患者3),1例部分缓解(PR)(患者4),1例保持疾病稳定(SD)状态但CLL1阳性AML幼稚细胞清除(患者6)。见表2。
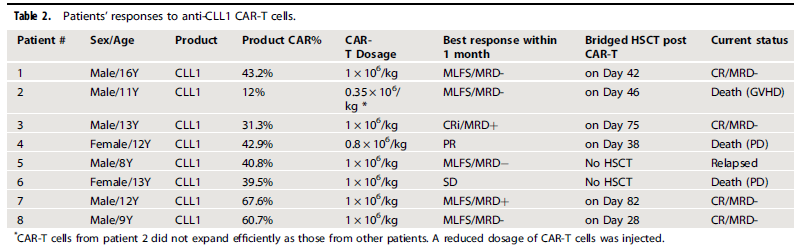
表2 CLL1 CAR-T治疗反应
●生存随访
患者5和6后续未桥接allo-HSCT,其余患者自CAR-T至allo-HSCT的中位间隔时间为44 天(28~82 天)。患者2在二次移植后2个月时再次复发,死于移植物抗宿主病(GVHD)。患者4在移植后6个月复发,死于疾病进展(PD)。
患者1、3、7和8仍持续CR状态生存,最长随访26个月。患者5在CR持续12个月后复发。患者6在CAR-T回输后第21天开始化疗,2个月时出现严重肺部感染和PD,最终死亡。见图1。
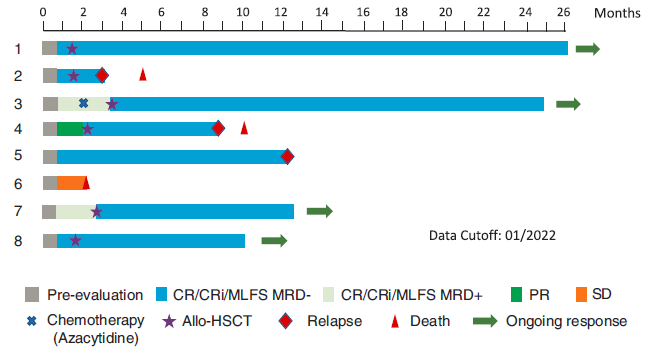
图1 CLL1 CAR-T治疗后患者反应持续时间及生存
研究结论
本研究结果表明,CLL1 CAR-T治疗儿童R/R-AML显示了理想的靶向能力,疗效令人鼓舞,且耐受性良好、不良反应可控,是一种安全有效的治疗选择,临床应用前景广阔。但初步结果显示其无法达到治愈,后续桥接allo-HSCT可能更为有益。
专家介绍

李春富
·高博医学(血液病)研究中心儿童血液病与肿瘤学科带头人、造血干细胞移植学科带头人
·高博医学(血液病)广东研究中心南方春富(儿童)血液病研究院院长
·曾任南方医科大学南方医院儿科主任、教授、硕士和博士导师
·美国血液病协会会员
·中华造血干细胞移植学组委员
·中国国家儿童医学中心血液/肿瘤专科联盟委员
·广东省地中海贫血防治协会创立者、名誉会长
·2017年“宋庆龄儿科医学奖”获得者
·主要从事血液病诊治,擅长儿童血液疾病包括地中海贫血(地贫)、白血病、淋巴瘤和嗜血细胞性淋巴组织细胞增多等。
·发表论文于《Blood》、《Blood Advance》和《Br J Haemato》等顶级学刊。近3年,曾5次在美国血液学年会(ASH)和欧洲血液学年会(EHA)上发表口头报告。已完成各类儿童造血干细胞移植超1000例。

张辉
国家儿童医学中心上海儿童医学中心
血液肿瘤科博士研究生,硕士研究生导师。
专注儿童血液肿瘤疾病诊治,从事小儿血液病临床和基础-临床转化研究,尤其在儿童白血病领域。
2013-2017年,于全球顶尖儿童癌症研究医院(St. Jude Children’s Research Hospital)进行儿童白血病临床转化的博士后工作。期间,作为美国St. Baldrick Foundation儿童肿瘤基金委第一个资助的中国学者,主持 “Pharmacogenomics of High-Risk Childhood Leukemia in China”项目(研究经费:350万)。2017年9月至2021年2月,任广州市妇女儿童医疗中心血液肿瘤科科主任。作为项目负责人,主持国家自然科学基金2项、广东省自然科学基金1项和广东省科技厅项目1项。2018年入选“广州市高层次卫生人才-医学重点人才”。以第一作者或通讯作者发表SCI论著20余篇,累计影响影子超过300分。
学术任职:中华医学会儿科学分会青年委员会秘书;中国抗癌协会小儿血液肿瘤分会委员;国家卫生健康委儿童血液病专家委员委员;福棠儿童医学发展研究中心儿童肿瘤专业委员会副主任委员。
