李智慧医生:从研究进展看CAR-T桥接移植治疗模式的临床应用与关键问题
近期,高博医学(血液病)北京研究中心北京高博博仁医院吴彤主任团队李智慧医生分别在Frontiers in Oncology和Transplantation and Cellular Therapy杂志上发表了两篇研究文章(图1),聚焦嵌合抗原受体T细胞(CAR-T)治疗缓解后桥接异基因造血干细胞移植(allo-HSCT)模式,在难治/复发急性B淋巴细胞白血病(r/r B-ALL)和难治/复发急性T淋巴细胞白血病(r/r T-ALL)或T淋巴母细胞淋巴瘤(T-LBL)患者中的应用探索。


图1 两篇研究文章均已在线发表
那么它们各自的治疗效果如何?其中有哪些重点问题值得我们关注?对临床实践又有怎样的启示?近期我们采访到李智慧医生,请她为我们解读研究背后的关键信息。
CAR-T缓解后桥接移植,有望带来r/r B-ALL患者生存期延长的“二次跃迁”
r/r B-ALL患者预后通常较差,CAR-T细胞治疗是近年来出现的一种新的免疫治疗方法,显著提高了此类患者的完全缓解(CR)率。然而,仅接受CAR-T治疗的CR患者中有超过50%在一年内复发。CAR-T治疗后桥接allo-HSCT可能是进一步改善r/r B-ALL患者预后的一种有效治疗策略。
1、研究概述
该研究对137例在CD19/CD22 CAR-T缓解后桥接allo-HSCT的r/r B-ALL患者进行了长期随访和统计分析。研究结果显示,通过CAR-T缓解后桥接allo-HSCT的患者中,1年和2年累积复发率(CIR)分别为23.7%和31.5%。1年和2年总生存(OS)率分别为80.4%和71.4%。1年和2年无病生存(DFS)率分别为71.0%和60.5%。41例(29.9%)患者移植后复发,微小残留病(MRD)阴性患者的复发率为23.8%(24/101),MRD阳性患者的复发率为47.2%(17/36)。
单因素分析显示,接受以全身放疗(TBI)为基础的预处理方案患者DFS显著高于接受以白消安(BU)为基础的预处理方案的患者;而移植前MRD阳性患者的复发或死亡风险显著高于MRD阴性患者。此外,研究发现,肿瘤TP53突变和胚系EP300突变是DFS和OS的独立危险因素。
总的来说,该研究显示,在137例 r/r B-ALL患者中,接受CAR-T缓解后桥接allo-HSCT的患者2年OS率和DFS率分别为71.4% 和60.5%。MRD阴性患者的2年OS率和DFS率分别为80.9%和69.3%。多因素Cox回归分析临床特征、基因突变谱与预后关系显示,移植前MRD阳性、胚系EP300突变和肿瘤TP53突变与移植后不良预后相关。
详细研究介绍请点击链接查看:李智慧医生:CAR-T缓解后桥接异基因移植显著提高r/r B-ALL患者预后,但应注意MRD状态和分子变异特点
2、研究解读
重视遗传易感基因和肿瘤突变基因对患者预后的影响
在本次研究中,除了CAR-T缓解后桥接allo-HSCT在r/r B-ALL患者中的疗效和安全性情况外,还有一点值得特别关注,那就是胚系遗传易感基因变异和肿瘤突变基因谱对患者预后的影响。
研究纳入的137例患者中,87例分析了遗传易感基因变异,92例使用二代测序(NGS)分析了肿瘤突变基因,67例同时进行了遗传易感基因变异和肿瘤突变基因变异测序。对这两类基因变异中高突变频率基因的DFS和OS进行单因素分析显示:胚系EP300突变患者的DFS和OS显著低于EP300野生型患者(图2),TP53突变患者的DFS和OS也明显低于TP53野生型患者(图3)。
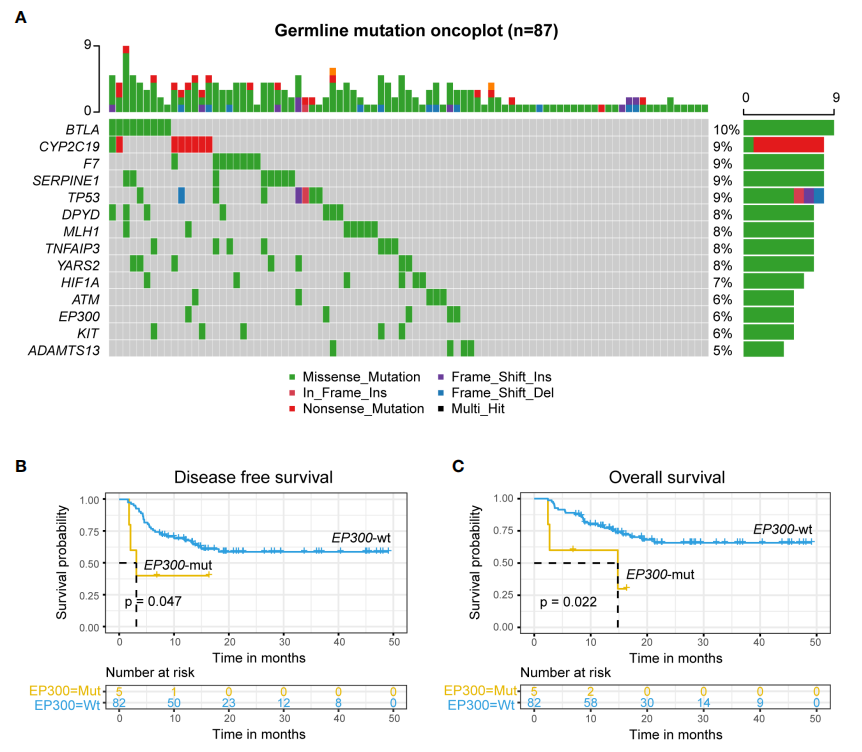
图2 胚系EP300突变患者的DFS和OS显著低于EP300野生型患者
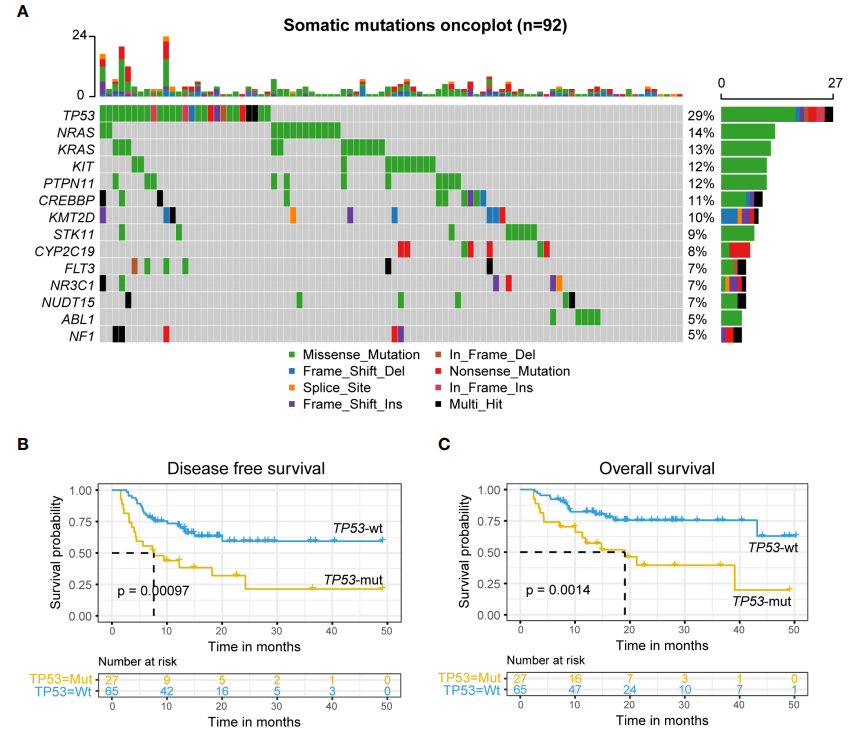
图3 TP53突变患者的DFS和OS明显低于TP53野生型患者
由此可见,胚系EP300突变和肿瘤TP53突变是DFS和OS的独立危险因素,是r/r B-ALL患者在CAR-T缓解后桥接异基因移植的不良预后因素。
其实对于遗传易感基因变异和肿瘤突变基因变异与allo-HSCT后患者预后情况的关系,此前已有研究探索过。比如早在2020年美国血液学学会(ASH)上,李智慧医生口头报告了团队探讨血液肿瘤患者具有的遗传和获得性血液和免疫系统疾病相关的基因变异对allo-HSCT结果的影响;结果显示血液肿瘤患者具有的某些遗传和获得性血液和免疫系统疾病相关的基因变异对allo-HSCT的结果产生不良影响,比如增加复发、急性移植物抗宿主病(aGVHD)和感染的发生。
另外在2022年ASH年会中,李智慧医生代表团队报告了《血液系统疾病中胚系遗传易感基因的突变谱及其对异基因造血干细胞移植预后的影响》的研究成果。该项研究展示了血液疾病患者的胚系遗传易感基因变异以及B-ALL、T-ALL/LBL和AML中常见的基因变异谱,也揭示了部分突变基因与allo-HSCT后患者预后不良的关系(详情点击了解:ASH2022 | 李智慧医生:血液系统疾病中胚系遗传易感基因的突变谱及其对异基因移植预后的影响)。更多有关遗传易感基因变异和肿瘤突变基因变异对allo-HSCT预后的影响在持续探索中。
供者CD7 CAR-T桥接同一供者allo-HSCT:T系血液系统恶性肿瘤治疗方式的突破
T系血液肿瘤是一种具有侵袭性的恶性血液系统疾病,患者生存率低,难治复发患者预后情况更差。近年来,随着CAR-T等免疫治疗方式应用于临床,复发难治B系恶性血液系统肿瘤的治疗疗效得到了一定提升,但复发难治T系血液系统恶性肿瘤患者的长期生存问题仍然面临着巨大的挑战。
1、研究概述
本研究共纳入了12例r/r T-ALL或T-LBL患者,接受供者来源的CD7 CAR-T治疗后桥接allo-HSCT。平均随访301天,1年OS率为92%(95% CI,90.43%-93.57%),DFS率为57%(95% CI,21.72%-92.28%)。除了1例患者在移植后14天因多器官功能衰竭死亡,其余11例患者在最后一次随访时仍生存,并且是MRD阴性的完全缓解状态(MRD-CR)。
所有患者在CAR-T治疗后14天出现全血细胞减少,其中83%表现出3-4级白细胞减少。移植后28天,45%的患者出现中性粒细胞减少症,截止至移植后180天时,存在3-4级中性粒细胞减少和白细胞减少的比例仅为9%,贫血、血小板减少和全血细胞减少比例均较CAR-T后明显降低。
免疫重建方面,CAR-T细胞回输后4周,患者体内T、B、NK、NKT细胞显著耗尽。移植后总T细胞逐渐恢复,NK/NKT细胞也恢复。这表明通过allo-HSCT治疗,可以逐步实现CAR-T细胞治疗后的细胞免疫重建。
感染是移植后的主要并发症,除1例患者在移植后第14天死于感染诱导的细胞因子风暴引起的多器官衰竭外,所有感染均得到了良好的控制。
详细研究介绍请点击链接查看:李智慧医生:供者来源的CD7 CAR-T桥接同一供者异基因造血干细胞移植治疗T系血液系统恶性肿瘤,安全有效
2、研究解读
CAR-T桥接移植治疗模式可以促进患者造血和免疫系统重建
非肿瘤靶向毒性,通常是因为靶点为共享靶点,在正常组织同样表达,会被CAR-T识别攻击而引起的毒性。相较于输注B系CAR-T细胞之后出现B细胞缺陷,可以通过输注丙球蛋白补充,以T细胞为靶细胞的CAR-T疗法,大量清除体内自身T细胞后可能使患者出现严重的联合免疫缺陷。
本研究患者在接受供体CD7 CAR-T后桥接allo-HSCT,这在很大程度上可以纠正联合免疫缺陷,实现造血和免疫重建。研究结果提示,70%的患者在移植后3~4周存在CD7+ T细胞群,并且随着时间的推移,CD7+CD3+CD4+和CD7+CD3+CD8+细胞呈增加趋势。既往研究表明,CD7 CAR-T细胞治疗可能导致NK和其他免疫细胞完全耗尽,在本研究中,NK细胞和NKT细胞在CD7 CAR-T细胞输注后比例下降,但在移植后,T细胞总数逐渐恢复,NK/NKT细胞也在恢复。这表明CAR-T后桥接allo-HSCT可以实现患者的细胞免疫重建。
在体液免疫方面,移植后1个月和3个月的患者外周血中,B细胞比例明显增加;移植后3~6个月,血清IgM水平也成上升趋势。
控制感染不是“老生常谈”,更需要加强重视程度
体内大量清除T细胞后可能使患者出现严重联合免疫缺陷,从而导致感染的风险增加,而造血干细胞移植后感染问题也是最重要的并发症之一,因此在CD7 CAR-T桥接allo-HSCT之后,我们更应关注患者的感染问题管理。
在本次研究中,细菌感染是移植后的主要感染类型,占总感染数的41%,其次是病毒感染(32%)和真菌感染(27%)。虽然移植后感染发生率显著增加,但无感染相关死亡,并可以通过抗感染治疗控制病情。
掌握移植后感染发生的规律和有效预防感染事件的发生,对患者的生存和生活质量的提高具有重要作用。而恰当的CAR-T后桥接异基因移植的时间也是降低感染风险的关键因素,使患者感染可控。
综上,通过对不同患者人群CAR-T桥接异基因移植治疗方式的探索,我们在改善恶性血液肿瘤患者生存率方面也取得了新的突破。希望前期的研究能够为临床实践带来启示,让更多的复发难治性恶性血液病患者生存获益。
专家介绍

吴彤
·高博医学(血液病)北京研究中心北京高博博仁医院造血干细胞移植科主任,医疗院长。
·亚太骨髓移植学会学术委员会委员,中国抗癌协会血液肿瘤专业委员会常委及造血干细胞移植与细胞治疗学组副组长,血液病数字诊疗专业委员会主任委员,女医师协会靶向专业委员会副主任委员,中国医院协会血液学机构分会副主任委员。
·毕业于北京医科大学(现北京大学医学部)医疗系。1986年-2006年在北京大学人民医院血液病研究所历任住院医、主治医、副主任医师,从事血液病的诊断与治疗,自1987年起主要的工作领域为造血干细胞移植。2017年5月起任北京高博博仁医院造血干细胞移植科主任及医疗院长。1994年在中国医学科学院病毒学研究所进修病毒诊断学。1996年-2000年在美国NIH(国立卫生研究院)心肺血液所做博士后,主要研究方向为造血干细胞基因治疗。
·从事造血干细胞移植30余年,是国际知名的造血干细胞移植专家。有数千例移植经验,对移植方式的选择,重症移植物抗宿主病(GVHD)和感染的救治,难治/复发白血病的移植及移植后复发的防治,移植后的免疫治疗(针对白血病、病毒、真菌),老年白血病的移植,CART缓解后序贯移植,二次异基因移植等均有独到的成功经验。发表论文80余篇,在国际会议上发言数十次。
·中华医学会血液学分会会员,美国血液学会会员,国际血液学会会员,亚太骨髓移植学会(APBMT)会员及学术委员会委员,中国抗癌协会血液肿瘤专业委员会常委及造血干细胞移植与细胞治疗学组副组长,女医师协会靶向专业委员会副主任委员,女医师协会血液专业委员会常委,中国医师协会整合医学分会整合血液病专业委员会委员,中国医院协会血液学机构分会副主任委员。任《中华血液学杂志》、《Hematology/Oncology and Stem Cell Therapy》及《Blood中文版》编委,《Hematology and Oncology Discovery》执行主编。
·曾荣获优秀教师奖,英语教学二等奖,中华医学科技进步二等奖,北京市科技进步一等奖,解放军总后勤部科技进步二等奖,APBMT十佳论文奖及杰出发言奖。

李智慧
·高博医学(血液病)北京研究中心北京高博博仁医院血液二科(移植技术)三病区,副主任医师。
·首都医科大学医学博士
·血液病数字诊疗专业委员会副主任委员
·中国医药生物技术协会医药生物技术临床应用专业委员会委员
·中国抗癌协会血液肿瘤专业委员会委员
·全国肿瘤营养学会儿童肿瘤营养学会委员
·中国研究型医院学会感染与炎症放射学专业委员会委员
·北京癌症防治学会造血干细胞移植专业委员会委员
·长期深耕于血液内科临床工作及实验室研究工作,在造血干细胞移植(HSCT)治疗白血病、MDS、淋巴瘤、再生障碍性贫血、噬血细胞综合征等疾病及移植合并症的防治方面具有非常丰富的经验。
·在BMT,Frontiers in immunology,Transplantation and cellular therapy, Leukemia & lymphoma, Medicine等杂志发表数篇SCI文章。
·数次在美国血液年会ASH,欧洲血液年会EHA,欧洲骨髓移植年会EBMT,亚太骨髓移植年会APBMT等国际血液学大会上发言及壁报交流。
