病例实战 | B细胞淋巴瘤患儿一线治疗后9个月多处复发,异基因双靶点CAR-T序贯带来一线生机!
在中国免疫及靶向治疗高峰论坛暨高博第三届淋巴瘤&骨髓瘤国际高峰论坛上,高博医学(血液病)北京研究中心北京博仁医院刘英主任分享了题为“异基因双靶点CAR-T细胞序贯治疗1例移植后复发儿童B细胞淋巴瘤”的精彩报告,和与会专家分享凶险难治病例的诊治经验。
起病凶险,一线化疗达CR
基本信息:
4岁女孩,以纵膈巨大瘤灶于2019年2月起病;
肿瘤侵犯部位包括双锁骨上窝及腋窝淋巴结、纵膈巨大瘤灶(10cm×6cm×9.3cm)、左侧胸膜及胸背部软组织、腹主动脉左旁(2.1cm×2.5cm×5.1cm)、T1-4、9-10椎管、脑脊液和骨髓。
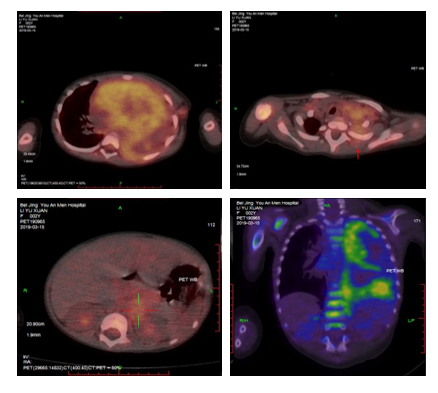
图1 患儿PET-CT检查
骨髓检查:
骨髓形态示原幼淋占87%;骨髓流式免疫分型和病理免疫组化均示异常增殖的细胞为恶性B细胞,但就恶性B细胞的分化阶段,免疫分型和免疫组化不全相同;流式示幼稚B细胞标志CD99阳性,考虑B淋母;病理免疫组化示幼稚B细胞标记CD99和TdT均阴性,成熟B细胞标记也没有阳性,倾向B淋母。
骨髓的分子异常有MLL/AF9阳性, KRAS基因突变,分子层面上支持B淋母诊断。
脑脊液流式示1.66%恶性幼稚B淋巴细胞。
诊断:
骨髓MICM整合诊断B淋巴母细胞淋巴瘤(白血病期CNS3高危组)。
一线治疗过程:
按照CNCL-2017-LBL高危组方案顺序完成VDLP+CAM×2+HR-1+HR-2+HR-3+ HR-1化疗。
中期评估骨髓和脑脊液微小残留病灶(MRD)均阴性,PET-CT示前纵膈瘤灶(4.0cm×2.2cm×3.5cm)缩小94.5%,残余少许肿瘤活性;3疗程巩固化疗后前纵膈瘤灶(1.9cm×2cm×2cm)较中期进一步缩小75%;4疗程巩固化疗后前纵膈瘤灶与前疗程相比大小无明显变化,其内可见钙化,考虑结构残迹。患儿达完全缓解(CR),于 2019年9月行同胞半相合造血干细胞移植。
移植后仅隔9个月复发,后续治疗何去何从?
患儿于移植后3个月PET-CT示前纵隔肿物完全消失,于移植后9月(2020-07-01) PET-CT发现新发瘤灶,分别位于左侧胸壁软组织(4.3cm×1.3cm×3.7cm)、双侧附件(左1.4cm×2.3cm×2.4cm,右4.0cm×3.4cm×4.1cm)及左侧肱骨中下段。
新发肿瘤组织的免疫组化示幼稚B细胞标记TDT(-)和CD99(少量+),倾向高级别B细胞淋巴瘤,NGS也检测到新的CARD11 基因突变,而初诊时的KRAS突变未检测到。尽管免疫表型和分子特征有一些改变,但肿瘤细胞的MLL/AF9基因仍阳性,故考虑原发病复发,诊断B淋巴母细胞淋巴瘤复发伴部分成熟B细胞转化(III期 CNS1)。
复发后,挽救治疗仍然进展
患儿于2020年7月至2020年9月在外院先后接受了供者淋巴细胞回输(DLI)、供者mCD19CAR-T细胞回输、供者hCD22CAR-T细胞回输和二次DLI,左侧卵巢肿物消失,而右侧卵巢肿物持续增大至6.2cm×5.2cm×5.0cm,卵巢肿物2次活检免疫表型仍示成熟B细胞表型,且于二次DLI回输后1周开始先后出现皮肤和肺的移植物抗宿主病(GVHD)。
多学科联合会诊,联合靶向治疗为后续CAR-T治疗保驾护航
患儿为进一步治疗转入我院。入我院后先采集并冻存了患者的外周血单个核细胞,以备后续CAR-T治疗。
患儿虽然发生了GVHD,但复发瘤灶并没有因为GVHD的出现而缩小或消失,依然持续增大,所以我们在治疗GVHD同时给予挽救性化疗。考虑卵巢肿物倾向成熟B细胞表型,我们选择成熟B细胞淋巴瘤的化疗方案。先用了两个疗程M2方案的化疗,左前胸壁肿物逐渐缩小;右卵巢肿物有部分反应,但化疗间歇期会有反复。故在肺GVHD治疗6周CT示右肺小气道陷闭程度明显减轻后,我们对患儿进行了多学科联合会诊,讨论再次行CAR-T治疗的可行性。
呼吸科张波主任认为:既然儿童闭塞性细支气管炎(BO)已经排除,再次CAR-T治疗有肺GVHD加重的风险,但不是绝对禁忌症;
移植科吴彤主任认为:根据既往经验,移植后合并内脏排异患儿再次给予CAR-T免疫治疗,因CAR-T后细胞因子风暴(CRS)导致内脏衰竭的风险高,不建议该患儿继续给予CAR-T治疗,可以考虑Blinatumomab双特异性抗体治疗,虽存在CRS风险,但此CRS比CAR-T后CRS轻,还可联合应用靶向药物BCL-2抑制剂和伊布替尼,伊布替尼可适当减轻GVHD症状。
分子检测实验室郑勤龙主任认为:加用伊布替尼靶向治疗,不仅可以减轻GVHD症状,还针对BCR通路上的CARD11 p.T532M基因变异。
我们根据会诊意见给予患儿Bite +伊布替尼+维奈托克联合靶向治疗,2周后右侧卵巢肿瘤增大,即停Bite,继续伊布替尼+维奈托克,同时给予CYVE化疗,肿瘤明显缩小。
异基因双靶点CAR-T序贯治疗带来全新希望
2020年1月20日肺GVHD治疗10周,CT示双肺透亮度恢复正常,提示患儿具备了再次行CAR-T治疗的条件;卵巢肿物第3次活检:组织流式免疫分型显示CD19和 CD22强表达,NGS未检测到CD19和CD22基因发生明确影响CD19CAR和CD22CAR结合的变异,提示虽然之前已做过CD19和CD22的CAR-T治疗,CD19和CD22仍可作为CAR-T治疗的靶点。基于此,建议患者入组博仁医院开展的CAR-T治疗临床研究。为避免外院CAR-T治疗后可能产生的抗体,我们先用人源CD19CAR,再序贯全人源CD19&CD22双靶点CAR;采用移植后HLA完全嵌合的受者外周血单个核细胞培养CAR-T细胞,这种异基因自体T细胞既有正常的T细胞功能,又在受者体内经历驯化,可降低GVHD的风险。
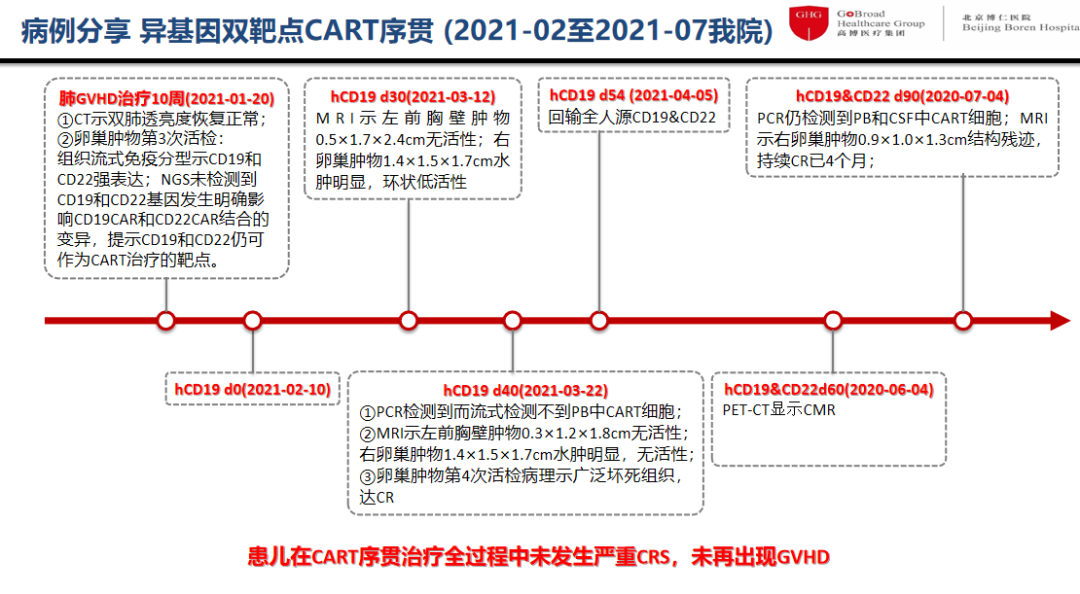
图2 异基因双靶点CAR-T序贯治疗过程
此患儿的CAR-T治疗不仅克服了肺GVHD的屏障,还利用CAR-T治疗新技术,包括供体CAR、双靶点CAR和序贯CAR-T以延长CAR-T细胞在体内的扩增时间,诱导持久的完全反应。
温故知新,集结CAR-T新技术,进一步积累临床实践经验
本病例属于高危B淋巴母细胞淋巴瘤/白血病,异基因造血干细胞移植后复发,且部分向成熟B细胞转化,传统DLI和挽救性化疗的效果有限。对于难治复发B细胞淋巴瘤,不论幼稚B还是成熟B,都可以考虑免疫靶向治疗,用于B细胞淋巴瘤的免疫靶向药包括BTK抑制剂、mTOR抑制剂、PIK3抑制剂、CD79b和CD19的抗体偶联药物、CD19和CD3双特异性抗体、CD19靶向CAR-T 等。
此患儿采取BTK抑制剂+Bcl2抑制剂+BiTE联合方案,以期达到免疫抗肿瘤同时减轻GVHD风险,但并未在短时间内控制肿瘤进展,患儿最终还是通过CAR-T治疗获得了CR。
我们用CAR-T治疗此例患者的目标不仅是为了获得CR,还要达到持久的CR甚至治愈。但是,单靶点CD19 CAR-T的长期疗效不如人意,治疗难治复发弥漫大B细胞淋巴瘤(DLBCL)的长期缓解率35%~40%,治疗B-ALL的1年无事件生存率(EFS)不足50%。
而CD19 CAR-T难以维持长期缓解的原因,一是CD19阴性复发,为CD19抗原表达的丢失或下调导致;另一种发生率更高的是CD19阳性复发,为CAR-T细胞在体内有限的生存时间及功能的耗竭所致。影响因素包括:采集T细胞的数量、质量和亚群,CAR的设计、转染和体外CAR-T细胞的增殖、回输前的肿瘤负荷、预化疗以及回输后的信号传导通路和肿瘤微环境等。
为了达到我们的治疗目标,我们在T细胞收集环节采用移植后HLA完全嵌合的自体T细胞制备CAR-T细胞以提高CAR-T细胞功能;在CAR设计环节,我们采用双抗原靶向CAR-T细胞克服抗原阴性复发;并用不同靶点CAR-T的序贯策略以延长CAR-T细胞在患者体内存在的时间。
异基因CAR-T细胞治疗移植后B细胞淋巴瘤
7个临床研究72例移植后复发B细胞肿瘤患者接受异基因CAR-T细胞治疗的疗效和安全性的Meta分析如下:
异基因CAR-T细胞种类:异基因供者CAR-T或异基因自体 CAR-T,其T细胞的功能强于移植前自体T细胞的功能;
异基因CAR-T细胞回输的窗口时间:移植后55-200天;
异基因CAR-T细胞回输剂量:0.4×106 –5×108 CAR-T cells/kg;
异基因CAR-T细胞适应证:移植后B细胞肿瘤的复发预防、MRD清除和复发后挽救治疗;
客观缓解率(ORR)达90%以上;
严重CRS及神经毒性发生率低;
仅5例(6.9%)发生GVHD。
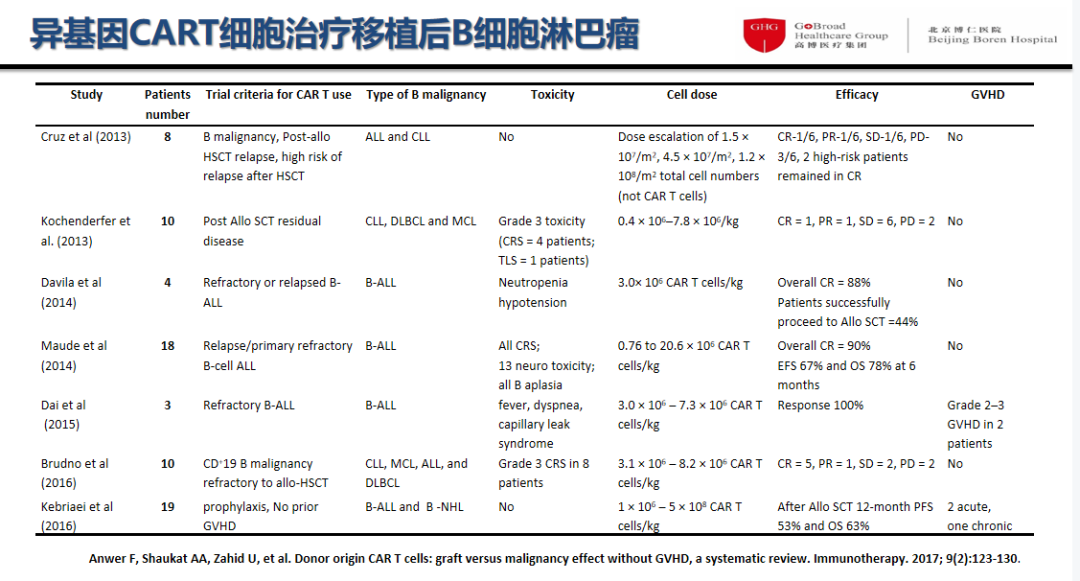
图3 Meta分析结果
双靶点CAR-T细胞治疗难治复发B细胞淋巴瘤
韩卫东教授关于CD19/CD20双靶点CAR-T的基础和临床研究结果显示:双靶点CAR-T细胞相比单靶点CAR-T细胞,具有较强的细胞毒杀伤功能,而分泌细胞因子较少,相应CRS反应较轻,在体内的耗竭减少,反应持续时间相对较长,治疗28例难治复发B细胞淋巴瘤患者的1年无进展生存率(PFS)提高至64%。
CAR-T细胞序贯治疗儿童难治复发成熟B细胞淋巴瘤
张永红教授领导的北京博仁医院儿童淋巴瘤科进行了不同B细胞靶点序贯治疗难治复发儿童B细胞淋巴瘤的I、II期临床研究和双靶点CAR-T治疗难治复发儿童B细胞淋巴瘤的I期临床研究。对入组I期的23例伯基特淋巴瘤患者进行了长期随访,截止至今年3月份,中位随访时间17个月。最初5例患者的短期疗效报道已在BLOOD发表,总结长期疗效的文章已被Blood Advances接收。
通过不同B细胞靶点CAR-T细胞序贯来延长CAR-T细胞作用时间的关键在于序贯时机。如果序贯早了,可能会提前终止前一靶点CAR-T细胞的作用,如果序贯晚了,肿瘤可能会在下一靶点CAR-T细胞回输前进展或复发。所以我们根据CAR-T疗效评估结果和外周血CAR-T细胞数共同决定序贯时机:待CRS反应基本消失、外周血细胞恢复至安全水平时,流式检测不到CAR-T细胞而PCR方法仍能检测到CAR-T细胞时瘤灶仍有残留者以及达CR2需巩固治疗者或者流式仍能检测到CAR-T细胞而瘤灶进展以及出现新发瘤灶者,可考虑进行下一个B细胞靶点的序贯。
入组I期临床的23例患者中,21例在最后1次CAR-T回输后获得CR,18例(86%)在最后1次CAR-T回输后至1年半仍能维持CR。截止至今年3月份,最长持续缓解时间是34个月,23例患者预期1年半PFS 为78%,其中巨大瘤灶组78%,中枢受累者60%。23例患者中8例发生III级CRS,5例发生III级中枢毒性,所有不良事件均可控可复;中枢受累组与非中枢受累组的严重中枢毒性无显著差异。
我们的研究结果显示:序贯CAR-T治疗可以在难治复发B细胞淋巴瘤患者体内诱导持久的完全反应,合并巨大瘤灶或中枢受累的难治复发B细胞淋巴瘤患儿可以从序贯CAR-T治疗中获益。
病例总结
B淋巴母细胞淋巴瘤/白血病在化疗和移植的压力选择下可以向成熟B细胞转化;
DLI和挽救化疗对异基因移植后复发的B细胞肿瘤疗效有限;
Bite难以在短时间内控制B细胞淋巴瘤的进展;
CAR-T细胞兼有DLI和Bite的双重功效,可兼治幼稚B细胞淋巴瘤和成熟B细胞淋巴瘤,且异基因自体CAR-T相比DLI有更高的安全性;
从单靶点CAR-T到双靶点CAR-T以致多靶点CAR-T的序贯,从自体CAR-T到异体CAR-T均是为了延长CAR-T细胞在体内的生存时间,诱导持久的完全反应。
最后,感谢所有参与CAR-T临床试验的患者及其亲属、朋友、志愿者,治疗的成功离不开所有人的信任、配合和坚持!同时感谢所有参与CAR-T临床试验的团队专家及成员,研究成果离不开你们的支持、指导和付出!
